Química Orgánica
viernes, 15 de noviembre de 2019
viernes, 8 de noviembre de 2019
viernes, 18 de octubre de 2019
viernes, 11 de octubre de 2019
Semana | N° 36
Isomeria
se refiere a la existencia de dos o más sustancias que poseen la misma fórmula molecular, pero cuya estructura es diferente en cada uno de los compuestos. En estas sustancias, conocidas como isómeros, se presentan todos los elementos en la misma proporción, pero conformando una estructuración de los átomos que es diferente en cada molécula
Se clasifican en:
-Isomeria estructural
- Isomeros de cadena
- isomeros de posicion
- Isomeros de Funcion
-Isomeria Optica
-Isomeria conformacional
Combustion
La Combustión es un proceso químico de oxidación rápida que va acompañado de desprendimiento de energía bajo en forma de calor y luz. Para que éste proceso se dé, es necesario la presencia de un combustible, un comburente y calor.El material que es capaz de arder y se combina con el oxígeno, se conoce como combustible.
- Combustión completa:Toda combustión completa libera, como producto de la reacción, dióxido de carbono (CO2) y agua en estado de vapor (H2O); no importa cuál sea el combustible a quemar. Estas sustancias no son tóxicas, pero el dióxido de carbono es el mayor responsable del recalentamiento global.
- combustion Incompleta: Los productos de la combustión incompleta varían según la cantidad de oxígeno disponible. Generalmente se forma monóxido de carbono (CO), gas sumamente tóxico. Esta sustancia produce la muerte por asfixia, ya que se combina con la hemoglobina de la sangre a una velocidad mayor que la del oxígeno.
viernes, 4 de octubre de 2019
Semana | N° 35
Partes de una reacción química
Sustrato: es típicamente la especie química que se observa en una reacción química, que reacciona con un reactivo para generar un producto. En química sintética y orgánica, el sustrato es el químico de interés que se está modificando.
Reactivo: Un reactivo es una sustancia o compuesto añadido a un sistema para provocar una reacción química, o añadido a probar si se produce una reacción
Producto Principal: Es lo que se espera de una reacción
Subproducto: es algo que se forma y no se busca en la reacción.
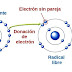
Radicales Libres: un radical es una especie química, caracterizada por poseer uno o más electrones desapareados. Se forma en el intermedio de reacciones químicas, a partir de la ruptura homolítica de una molécula y, en general, es extremadamente inestable y, por tanto, con gran poder reactivo y de vida media muy corta.
Ruptura homolítica: En química se denomina homólisis o ruptura homolítica a la ruptura de un enlace químico en el que cada átomo participante del enlace retiene un electrón del par que constituía la unión formándose dos radicales
Ruptura Heterolitica: En química se denomina heterólisis o ruptura heterolítica a la ruptura de un enlace químico de una molécula neutral que genera un catión y un anión. En este proceso, los dos electrones que constituyen el enlace son asignados al mismo fragmento.
viernes, 27 de septiembre de 2019
Semana | N° 34
COMPUESTOS ORGÁNICOS
Naftaleno: es un sólido blanco que se volatiliza fácilmente y se produce naturalmente cuando se queman combustibles. También se llama alquitrán blanco y se ha usado en bolas y escamas para ahuyentar las polillas.
Urea: La urea es un compuesto químico cristalino e incoloro; de fórmula CO(NH₂)₂. Se encuentra abundantemente en la orina y en la materia fecal. Es el principal producto terminal del metabolismo de las proteínas en el humano y en los demás mamíferos.
Tetracloruro de carbono : es un compuesto químico sintético, organoclorado, no inflamable, antiguamente utilizado como extintor y en la producción de refrigerantes, pero actualmente abandonado debido a su toxicidad. Es un líquido incoloro de olor ligeramente dulce.
Lactosa : La lactosa es el principal azúcar (o carbohidrato) de origen natural que hay en la leche y los productos lácteos. La lactosa está formada por glucosa y galactosa, dos azúcares simples que el cuerpo utiliza directamente como fuente de energía. La enzima lactasa descompone la lactosa en glucosa y galactosa.
Formol: El formaldehído o metanal es un compuesto químico, más específicamente un aldehído altamente volátil y muy inflamable, de fórmula H₂C=O. Se obtiene por oxidación catalítica del alcohol metílico.
Ácido etanoico: puede encontrarse en forma de ion acetato. Se encuentra en el vinagre, y es el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC, se denomina sistemáticamente ácido etanoico.
AldehidosY Cetonas
Reactivo de Fehling
Es una disolución descubierta por el químico alemán Hermann von Fehling y que se utiliza como reactivo para la determinación de azúcares reductores. Sirve para demostrar la presencia de glusosa, así como para detectar derivados de ésta tales como la sacarosa o la fructosa. El licor de Fehling consiste en dos soluciones acuosas:
- Sulfato de cobre cristalizado, 35 g y agua destilad hasta 1.000 mL.
- Sal de Seignette o Tartrato mixto de potasio y sodio 150 g, solución de hidróxido de sodio al 40 %, 3 g y agua hasta 1.000 mL.
Acido solfonico: Los ácidos sulfónicos y sus sales sulfonato son ampliamente usados en diversos productos, tales como detergentes, drogas antibacteriales sulfas, resinas de intercambio aniónico (purificación de agua) y tintes.
Ácido Cítrico: El ácido cítrico es un ácido orgánico tricarboxílico, presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja.
viernes, 20 de septiembre de 2019
Semana | N° 33
Activación-desactivación
Los sustituyentes presentes sobre un compuesto aromático influyen fuertemente en su reactividad. Estos sustituyentes o grupos se clasifican en: activantes o desactivantes. Los primeros provocan que la reacción sea más rápida que en el compuesto no sustituido y los segundos lo contrario. Un grupo o sustituyente será activante si cede densidad electrónica al sistema aromático o desactivante si en cambio atrae electrones.
Grupos activantes
Un grupo activante es aquel cuya presencia aumenta la reactividad, la velocidad de reacción, del anillo aromático frente a la sustitución electrófila aromática respecto a cuando ese grupo está ausente. La introducción de un grupo activante en un compuesto aromático no sustituido conducirá frecuentemente a una polisustitución.
Este aumento de la velocidad de reacción se debe a que estos grupos estabilizan el intermedio catiónico formado durante la sustitución a través de la cesión de densidad electrónica sobre el sistema anular, ya sea por efecto inductivo o por efecto resonante (o mesomero). Esto implica que la barrera o energía de activación disminuya para la primera etapa de la reacción, que es la que controla la velocidad global de la misma.
Activación por efecto inductivo:
Los alquilos son activantes débiles por efecto inductivo (y también por hiperconjugación). El efecto inductivo está controlado por la electronegatividad. Un ejemplo de un anillo aromático débilmente activado por un sustituyente alquilo es el tolueno.
Activación donde predomina el efecto resonante:
Los grupos que pueden ceder por resonancia pares de electrones no compartidos al sistema π son activantes. Grupos activantes por resonancia son las funciones amino, hidroxi y sus derivados.
Anilina, ejemplo de anillo aromático fuertemente activado
En la anilina el grupo amino, dada la mayor electronegatividad del átomo de nitrógeno respecto al de carbono, es atrayente de electrones por efecto inductivo. En cambio por efecto resonante es dador de electrones, ya que tiene un par de electrones sin compartir que pueden deslocalizarse por el anillo aromático. En este caso el efecto resonante domina sobre el inductivo, y el efecto global es que la anilina está fuertemente activada frente a la sustitución electrófila aromática. Otro ejemplo sería el fenol.
Grupos desactivantes
Un grupo desactivante es aquel cuya presencia disminuye la reactividad, la velocidad de reacción, del anillo aromático frente a la sustitución electrófila aromática respecto a cuando ese grupo está ausente. Por tanto la introducción de un grupo desactivante en un compuesto aromático no sustituido hará más difícil, condiciones más agresivas, una segunda sustitución.
Esta disminución de la velocidad de reacción se debe a que estos grupos desestabilizan el intermedio catiónico. Esto es así debido a que son grupos que retiran densidad electrónica del sistema aromático, ya sea por efecto inductivo o por efecto resonante. Esto supone que la barrera o energía de activación de la primera etapa se eleve, y por tanto disminuya la reactividad.
Ácido benzoico, ejemplo de anillo muy desactivado.
Otros ejemplo de compuestos fuertemente desactivados son el nitrobenceno, el benzaldehído o el (trifluorometil)-benceno (Ph-CF3).
Los halobencenos, (Ph-X donde X = F, Cl, Br o I), dada la electronegatividad de los halógenos, están ligeramente desactivados por efecto inductivo.
| Activantes fuertes | Desactivantes fuertes |
|---|---|
| -NH2, -NHR, -NR2 -NHCOR, -OCOR -OH, -OR | -NO2, -CF3, -N+R3 -COOH, -COOR, -COR -SO3H, -CN |
| Activantes débiles | Desactivantes débiles |
| -Alquilo,-Arilo | -halógeno |
Suscribirse a:
Entradas (Atom)
Semana | N° 39
Se realiza taller en parejas
-
Partes de una reacción química Sustrato: es típicamente la especie química que se observa en una reacción química, que reacciona ...
-
Activación-desactivación Los sustituyentes presentes sobre un compuesto aromático influyen fuertemente en su reactividad. Estos sustituye...
-
Se realiza taller en parejas